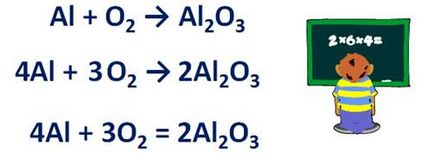ecuații chimice
Lecția 27. Chimia gradul 8
Lecții Sinopsis „ecuație chimică“
În baza legii conservării substanțelor în masă constituie ecuație chimică ecuație reaktsiy.Himicheskoe - înregistrarea reacției chimice condițional cu formule și simboluri chimice.
Partea stângă a ecuației este scrisă cu formula sau formula substanțelor care au intrat în reacție chimică. Ele sunt numite precursori. între „plus“ semnul de pe partea dreaptă a ecuației este scrisă cu formula sau formula produșilor de reacție. și anume substanțele care se formează prin reacția dintre ele a pus, de asemenea, semnul „plus“, iar între partea stângă și partea dreaptă a ecuației pune săgeată.
Reacția chimică poate fi reprezentată prin ecuația molecular. Ie ecuație molecular - această ecuație, în care materiile prime și produsele de reacție sunt înregistrate sub formă de molecule. Dacă un precipitat format în reacție. dreptul de lângă el pune în jos (↓), iar în cazul în care se degajă gaz. apoi chiar lângă el pune săgeata în sus (↑).
După înregistrarea schema ecuației nahodyatkoeffitsienty. și anume Cifrele care se confruntă cu substanțe cu formulele la numărul de atomi înainte și după reacția au fost identice.
De exemplu, putem scrie ecuația reacția hidrogenului cu oxigenul. Inițial, indicăm substanțele cu formula care au intrat în reacție chimică - este hidrogen (H2) și oxigen (O2), stabilit între „plus“ semn, format prin reacția apei - H2O Între substanță din stânga și dreapta a săgeții set. Să vedem cât de mulți atomi de hidrogen de pe stânga și dreapta. Doi atomi de hidrogen sunt obținute înainte și după reacție, și atomul de oxigen la reacția 2, după reacția - atom. Prin urmare, partea dreapta a formulei stabilite înainte de factorul de apă 2. Dar acum partea dreaptă a ecuației 4 a devenit un atom de hidrogen, iar stânga doar 2. Pentru a egaliza numărul de atomi de hidrogen necesar la stânga față a aprovizionării hidrogenului 2. Deoarece coeficientul am egalat numărul tuturor atomilor din partea stângă și dreaptă a ecuației, acesta devine acum nu o săgeată și un semn egal.
Pentru selectarea corectă a coeficienților din ecuația reacției trebuie efectuată de mai mulți factori:
Înainte de a formula substanțe · simple pot înregistra un factor de fracționare. De exemplu, în reacția de ardere butan:
C4 H10 O2 → CO2 + H2O + CO2 Înainte formula stabilită factorul 4, deoarece reacția dintre a 4 atomi de carbon, raportul apă stabilit prin formula 5, ca reacția dintre a 10 atomi de hidrogen. Reacția se produce cu 13 atomi de oxigen și până la 2 atomi de reacție, mijloace de a furniza necesarul de oxigen formula factor 6.5. Si din moment ce coeficientul arată nu numai numărul de atomi și molecule, dar este necesar să se dubleze raportul în Ec. Deci, ecuația ar fi: 2C4 H10 + 13O2 → 8SO2 + 10N2 despre.
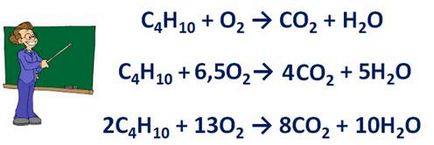
· Dacă în schema de reacție este o sare, primul egaliza numărul de ioni care formează sare. De exemplu, reacția acidului fosforic și hidroxid de calciu format sare - fosfat de calciu și apă.
H3 PO4 + Ca (OH) 2 → Ca3 (PO4) 2 + H2O Această sare este format din ioni fosfat cu o șarjă de 3 și calciu ioni cu sarcină 2+. Egaliza numerele lor, înainte specificând formula 2 raportul dintre acid fosforic și hidroxid de calciu cu formula - raportul 3.
· Dacă în schema de reacție sunt atomi de hidrogen și oxigen, primii atomi de hidrogen egalizate și apoi numai oxigen. Din schema anterioară arată că, în partea stângă a ecuației 12 atomi de hidrogen din dreapta - 2 înseamnă numai că, înainte ca apa să formula trebuie coeficientului 6. Se calculează numărul de atomi de oxigen. Până la reacția 14, după ce reacția este de asemenea posibil, în loc de 14. Prin urmare, săgeata echivalează.
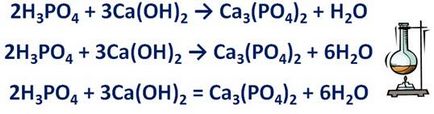
· Dacă în schema de reacție, există mai multe săruri de formule, ar trebui să înceapă de egalizare cu ioni conținute în sarea care conține mai multe dintre ele. De exemplu, în reacția de azotat de bariu și sare sulfat de aluminiu format din două - sulfat de bariu și azotat de aluminiu. Cel mai mare număr de ioni conține o sare - azotat de aluminiu, cu toate acestea, mai întâi necesar pentru egalizarea ionilor, care este format prin această sare, adică, ioni de aluminiu și ionii de azotat. Ba (NO3) 2 + Al2 (SO4) 3 → BaSO4 + Al (NO3) 3. Responsabil aluminiu 3+ ionii de nitrat - 1-. Prin urmare, coeficientul stabilit 3. Înainte de formula Al2 (SO4) 3 trebuie să furnizeze coeficientul 1, în partea stângă a ecuației cu formula Ba (NO3) 2, dar nu este atribuit. Egalizează ionii rămași. ionii de bariu în reacția 3, în urma reacției 1, deci înainte de BaSO4 formula set raportul 3, ionii de azotat înainte de reacție 6, deci Al-dreapta față (NO3) 3 raport stabilit 2. Numărul de atomi de aluminiu aceeași reacție și după aceea, t .E. 2. ionii de bariu și ioni sulfat înainte de reacție și după reacție sunt la fel - 3.
· Dacă numărul de atomi ai elementului într-o singură bucată, chiar schema de ecuații, iar celălalt este ciudat, este necesar să se formula cu un număr impar de atomi livreze un factor de 2 și apoi egaliza numărul tuturor atomilor. De exemplu, pentru a plasa coeficienții în reacția aluminiului cu oxigenul. Al + O2 → Al2 O3. Reacția este formată din oxid de aluminiu - Al2 O3. Numărul de atomi de oxigen la reacție chiar, adică este de două, și ciudat după reacția - 3. Prin urmare, înainte de alumină de stabilit factorul formula de 2. Ca rezultat, am devenit 6 atomi de oxigen, după reacție, înseamnă, în partea stângă a formulei coeficientului de oxigen setat 3. Începe să egalizeze numărul de atomi de aluminiu și în sus după reacție. Înainte de reacție 1 atom după reacția - 4. Prin urmare, în partea stângă a formulei la raportul de aluminiu setat 4. Acum numărul de atomi din fiecare element chimic în partea stângă și dreaptă a ecuației este la fel de circuit, iar săgeata ar trebui să fie înlocuită cu un semn egal.